摘要:新研究表明,通過(guò)小膜泡提供了靶向癌癥治療的方法可以減少腫瘤的生長(zhǎng),提高小鼠的存活率。
瑞典卡羅林斯卡學(xué)院的研究人員已經(jīng)成功地通過(guò)我們的細(xì)胞用來(lái)交流的小膜泡提供了靶向癌癥治療。一項(xiàng)新的研究發(fā)表在Nature Biomedical Engineering表明這種治療可以減少腫瘤的生長(zhǎng),提高小鼠的存活率。
當(dāng)我們的細(xì)胞交流時(shí),它們會(huì)發(fā)出一種叫做細(xì)胞外囊泡的小膜泡,其中含有各種信號(hào)分子。這些小氣泡有時(shí)被稱(chēng)為人體的“瓶中信息”,近年來(lái)人們對(duì)它們的興趣越來(lái)越大,因?yàn)樗鼈兛梢杂脕?lái)輸送藥物。

圖1 抗體擴(kuò)散細(xì)胞外小泡用于癌癥靶向治療
抗體尋找腫瘤
卡羅林斯卡學(xué)院的研究人員現(xiàn)在已經(jīng)創(chuàng)造出一種靶向癌癥治療方法,他們?cè)谶@些氣泡上裝載化療藥物,并在氣泡表面附著針對(duì)腫瘤的抗體。除了靶向腫瘤細(xì)胞外,抗體還作為免疫療法的一種形式,從而增強(qiáng)治療效果。當(dāng)注射給患有乳腺癌或黑色素瘤的小鼠時(shí),這種治療方法可以減少腫瘤的生長(zhǎng),提高生存率。
在癌癥治療領(lǐng)域,靶向療法和免疫療法已經(jīng)取得了顯著進(jìn)展,但如何將治療藥物更精確地送達(dá)腫瘤細(xì)胞仍是一個(gè)挑戰(zhàn)。近期,一項(xiàng)突破性研究展示了一種新型的癌癥治療策略:利用細(xì)胞外囊泡(Extracellular vesicles, EVs)作為藥物遞送系統(tǒng),實(shí)現(xiàn)對(duì)腫瘤的精準(zhǔn)打擊。
細(xì)胞外囊泡是細(xì)胞分泌的自然納米囊泡,它們?cè)诮M織間傳遞生物信號(hào)和分子中起著關(guān)鍵作用。研究團(tuán)隊(duì)發(fā)現(xiàn),通過(guò)分子工程手段,可以改造EVs,使其表面帶有針對(duì)抗體可結(jié)晶片段(Fc domain)的結(jié)合基團(tuán)。這種改造后的EVs能夠結(jié)合不同類(lèi)型的免疫球蛋白G抗體,從而被導(dǎo)向至幾乎任何感興趣的組織。
研究中,工程化的EVs被優(yōu)化,以確保它們能夠結(jié)合Fc片段并正確地進(jìn)行EVs排序。研究結(jié)果表明,這些EVs能夠針對(duì)表達(dá)人表皮生長(zhǎng)因子受體2(HER2)或程序性死亡配體1(PD-L1)的癌細(xì)胞。當(dāng)這些EVs攜帶化療藥物多柔比星(doxorubicin)并被系統(tǒng)性注射到患有皮下黑色素瘤的小鼠體內(nèi)時(shí),能夠顯著降低腫瘤負(fù)擔(dān)并延長(zhǎng)小鼠的生存期。
這項(xiàng)技術(shù)的一個(gè)關(guān)鍵優(yōu)勢(shì)在于其模塊化特點(diǎn),使得EVs可以適應(yīng)多種不同的Fc融合蛋白、雙特異性抗體和抗體-藥物偶聯(lián)物。這為開(kāi)發(fā)新的癌癥治療策略提供了廣闊的空間,尤其是在提高藥物的靶向性和減少副作用方面。
研究還指出,盡管PD-L1在多種惡性腫瘤中過(guò)表達(dá),但只有一部分患者對(duì)免疫檢查點(diǎn)抑制劑有持久反應(yīng)。通過(guò)結(jié)合化療、多重免疫檢查點(diǎn)抑制和其他免疫刺激策略,可以提高響應(yīng)率,但這些策略在將不同治療劑協(xié)調(diào)遞送到目標(biāo)方面存在限制。EVs作為一種有前景的藥物遞送納米載體,具有跨越生物屏障到達(dá)遠(yuǎn)距離器官的能力,并且可以被工程化以展示靶向基團(tuán),并裝載多種治療性貨物分子。
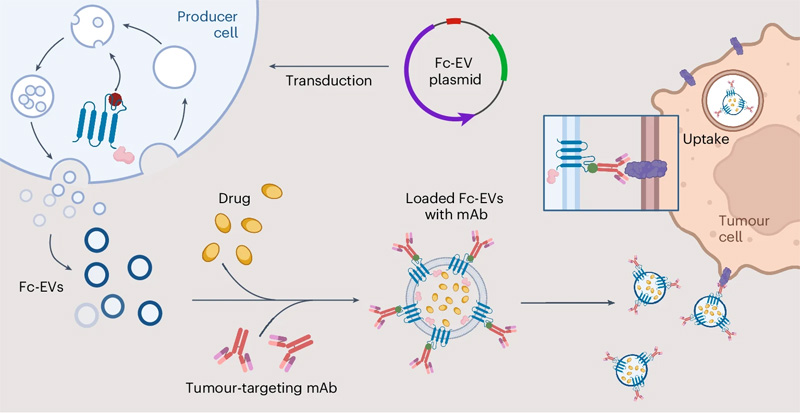
圖2 工程細(xì)胞以產(chǎn)生用Fc結(jié)構(gòu)域特異性抗體結(jié)合部分修飾的EV
更有效,副作用更少
研究人員希望,與目前的治療策略相比,新的治療方法將在不影響健康組織的情況下,更具體、更有效地消除腫瘤細(xì)胞。研究人員計(jì)劃調(diào)查抗體和藥物的不同組合是否能進(jìn)一步改善治療。
卡羅林斯卡醫(yī)學(xué)院檢驗(yàn)醫(yī)學(xué)系的醫(yī)生Oscar Wiklander說(shuō),他與同一部門(mén)的研究員Doste Mamand共同撰寫(xiě)了這項(xiàng)研究:“通過(guò)將不同的抗體附著在細(xì)胞外囊泡上,我們可以將它們定位到幾乎任何組織上,我們也可以將其他類(lèi)型的藥物裝載到它們上,因此,這種治療方法有可能用于治療其他疾病和癌癥類(lèi)型。”
“除此之外,我們還想研究將mRNA作為抗癌藥物傳遞的可能性,”該研究的最后一位作者、卡羅林斯卡醫(yī)學(xué)院檢驗(yàn)醫(yī)學(xué)系教授Samir EL Andaloussi說(shuō)。“最終,我們希望這能帶來(lái)一個(gè)新的治療平臺(tái),可以提高治療效果,減少對(duì)難以治療的疾病,尤其是癌癥的副作用。”
目前,EVs在臨床試驗(yàn)中的治療潛力正在被廣泛評(píng)估,這項(xiàng)研究提出的EV治療技術(shù)無(wú)疑為癌癥治療領(lǐng)域帶來(lái)了新的希望。隨著研究的深入,未來(lái)EVs可能成為癌癥治療中不可或缺的工具,為患者提供更有效、更安全的治療選擇。
細(xì)胞外囊泡技術(shù)的開(kāi)發(fā)為癌癥治療帶來(lái)了革命性的變革。通過(guò)精準(zhǔn)的藥物遞送,我們有望在未來(lái)看到癌癥治療的效果得到顯著提升,同時(shí)減少患者的痛苦和治療成本。隨著臨床試驗(yàn)的不斷推進(jìn),我們期待這項(xiàng)技術(shù)能夠早日應(yīng)用于臨床,造福廣大癌癥患者。
這項(xiàng)研究主要由瑞典癌癥協(xié)會(huì)、瑞典研究理事會(huì)、歐洲研究理事會(huì)(ERC)和CIMED資助。幾位作者在Evox治療公司有經(jīng)濟(jì)利益。
參考資料
[1] Antibody-displaying extracellular vesicles for targeted cancer therapy
摘要:新研究表明,通過(guò)小膜泡提供了靶向癌癥治療的方法可以減少腫瘤的生長(zhǎng),提高小鼠的存活率。
瑞典卡羅林斯卡學(xué)院的研究人員已經(jīng)成功地通過(guò)我們的細(xì)胞用來(lái)交流的小膜泡提供了靶向癌癥治療。一項(xiàng)新的研究發(fā)表在Nature Biomedical Engineering表明這種治療可以減少腫瘤的生長(zhǎng),提高小鼠的存活率。
當(dāng)我們的細(xì)胞交流時(shí),它們會(huì)發(fā)出一種叫做細(xì)胞外囊泡的小膜泡,其中含有各種信號(hào)分子。這些小氣泡有時(shí)被稱(chēng)為人體的“瓶中信息”,近年來(lái)人們對(duì)它們的興趣越來(lái)越大,因?yàn)樗鼈兛梢杂脕?lái)輸送藥物。

圖1 抗體擴(kuò)散細(xì)胞外小泡用于癌癥靶向治療
抗體尋找腫瘤
卡羅林斯卡學(xué)院的研究人員現(xiàn)在已經(jīng)創(chuàng)造出一種靶向癌癥治療方法,他們?cè)谶@些氣泡上裝載化療藥物,并在氣泡表面附著針對(duì)腫瘤的抗體。除了靶向腫瘤細(xì)胞外,抗體還作為免疫療法的一種形式,從而增強(qiáng)治療效果。當(dāng)注射給患有乳腺癌或黑色素瘤的小鼠時(shí),這種治療方法可以減少腫瘤的生長(zhǎng),提高生存率。
在癌癥治療領(lǐng)域,靶向療法和免疫療法已經(jīng)取得了顯著進(jìn)展,但如何將治療藥物更精確地送達(dá)腫瘤細(xì)胞仍是一個(gè)挑戰(zhàn)。近期,一項(xiàng)突破性研究展示了一種新型的癌癥治療策略:利用細(xì)胞外囊泡(Extracellular vesicles, EVs)作為藥物遞送系統(tǒng),實(shí)現(xiàn)對(duì)腫瘤的精準(zhǔn)打擊。
細(xì)胞外囊泡是細(xì)胞分泌的自然納米囊泡,它們?cè)诮M織間傳遞生物信號(hào)和分子中起著關(guān)鍵作用。研究團(tuán)隊(duì)發(fā)現(xiàn),通過(guò)分子工程手段,可以改造EVs,使其表面帶有針對(duì)抗體可結(jié)晶片段(Fc domain)的結(jié)合基團(tuán)。這種改造后的EVs能夠結(jié)合不同類(lèi)型的免疫球蛋白G抗體,從而被導(dǎo)向至幾乎任何感興趣的組織。
研究中,工程化的EVs被優(yōu)化,以確保它們能夠結(jié)合Fc片段并正確地進(jìn)行EVs排序。研究結(jié)果表明,這些EVs能夠針對(duì)表達(dá)人表皮生長(zhǎng)因子受體2(HER2)或程序性死亡配體1(PD-L1)的癌細(xì)胞。當(dāng)這些EVs攜帶化療藥物多柔比星(doxorubicin)并被系統(tǒng)性注射到患有皮下黑色素瘤的小鼠體內(nèi)時(shí),能夠顯著降低腫瘤負(fù)擔(dān)并延長(zhǎng)小鼠的生存期。
這項(xiàng)技術(shù)的一個(gè)關(guān)鍵優(yōu)勢(shì)在于其模塊化特點(diǎn),使得EVs可以適應(yīng)多種不同的Fc融合蛋白、雙特異性抗體和抗體-藥物偶聯(lián)物。這為開(kāi)發(fā)新的癌癥治療策略提供了廣闊的空間,尤其是在提高藥物的靶向性和減少副作用方面。
研究還指出,盡管PD-L1在多種惡性腫瘤中過(guò)表達(dá),但只有一部分患者對(duì)免疫檢查點(diǎn)抑制劑有持久反應(yīng)。通過(guò)結(jié)合化療、多重免疫檢查點(diǎn)抑制和其他免疫刺激策略,可以提高響應(yīng)率,但這些策略在將不同治療劑協(xié)調(diào)遞送到目標(biāo)方面存在限制。EVs作為一種有前景的藥物遞送納米載體,具有跨越生物屏障到達(dá)遠(yuǎn)距離器官的能力,并且可以被工程化以展示靶向基團(tuán),并裝載多種治療性貨物分子。

圖2 工程細(xì)胞以產(chǎn)生用Fc結(jié)構(gòu)域特異性抗體結(jié)合部分修飾的EV
更有效,副作用更少
研究人員希望,與目前的治療策略相比,新的治療方法將在不影響健康組織的情況下,更具體、更有效地消除腫瘤細(xì)胞。研究人員計(jì)劃調(diào)查抗體和藥物的不同組合是否能進(jìn)一步改善治療。
卡羅林斯卡醫(yī)學(xué)院檢驗(yàn)醫(yī)學(xué)系的醫(yī)生Oscar Wiklander說(shuō),他與同一部門(mén)的研究員Doste Mamand共同撰寫(xiě)了這項(xiàng)研究:“通過(guò)將不同的抗體附著在細(xì)胞外囊泡上,我們可以將它們定位到幾乎任何組織上,我們也可以將其他類(lèi)型的藥物裝載到它們上,因此,這種治療方法有可能用于治療其他疾病和癌癥類(lèi)型。”
“除此之外,我們還想研究將mRNA作為抗癌藥物傳遞的可能性,”該研究的最后一位作者、卡羅林斯卡醫(yī)學(xué)院檢驗(yàn)醫(yī)學(xué)系教授Samir EL Andaloussi說(shuō)。“最終,我們希望這能帶來(lái)一個(gè)新的治療平臺(tái),可以提高治療效果,減少對(duì)難以治療的疾病,尤其是癌癥的副作用。”
目前,EVs在臨床試驗(yàn)中的治療潛力正在被廣泛評(píng)估,這項(xiàng)研究提出的EV治療技術(shù)無(wú)疑為癌癥治療領(lǐng)域帶來(lái)了新的希望。隨著研究的深入,未來(lái)EVs可能成為癌癥治療中不可或缺的工具,為患者提供更有效、更安全的治療選擇。
細(xì)胞外囊泡技術(shù)的開(kāi)發(fā)為癌癥治療帶來(lái)了革命性的變革。通過(guò)精準(zhǔn)的藥物遞送,我們有望在未來(lái)看到癌癥治療的效果得到顯著提升,同時(shí)減少患者的痛苦和治療成本。隨著臨床試驗(yàn)的不斷推進(jìn),我們期待這項(xiàng)技術(shù)能夠早日應(yīng)用于臨床,造福廣大癌癥患者。
這項(xiàng)研究主要由瑞典癌癥協(xié)會(huì)、瑞典研究理事會(huì)、歐洲研究理事會(huì)(ERC)和CIMED資助。幾位作者在Evox治療公司有經(jīng)濟(jì)利益。
參考資料
[1] Antibody-displaying extracellular vesicles for targeted cancer therapy



