摘要:來自日本的研究人員探索了可溶性免疫檢查點(diǎn)分子作為預(yù)測(cè)性生物標(biāo)志物的潛力。
癌癥是一種普遍的疾病,細(xì)胞不受控制地分裂和生長(zhǎng),并最終擴(kuò)散到身體的其他部位或器官。非小細(xì)胞肺癌(NSCLC)是一種非常普遍的肺癌。目前針對(duì)非小細(xì)胞肺癌的治療策略包括使用免疫檢查點(diǎn)抑制劑(ICIs),因?yàn)樗鼈優(yōu)榉切〖?xì)胞肺癌患者提供了顯著的臨床益處。
ICIs靶向特異性免疫檢查點(diǎn)蛋白,如細(xì)胞毒性T淋巴細(xì)胞相關(guān)蛋白-4 (CTLA-4)和/或程序性細(xì)胞死亡-1 (PD-1)。腫瘤組織中PD-1配體(PD-L1)的表達(dá)(tPD-L1)目前被用作確定非小細(xì)胞肺癌患者PD-1或PD-L1靶向治療療效的生物標(biāo)志物。然而,由于tPD-L1表達(dá)的異質(zhì)性和預(yù)測(cè)價(jià)值不足,需要額外的生物標(biāo)志物。
在此背景下,來自日本的一組研究人員,包括近代大學(xué)醫(yī)學(xué)院腫瘤內(nèi)科的Hidetoshi Hayashi教授和Kazuhiko Nakagawa教授,以及京都大學(xué)醫(yī)學(xué)院免疫與基因組醫(yī)學(xué)系的Kenji Chamoto教授和Tasuku Honjo教授,已嘗試研究可溶性形式的免疫檢查點(diǎn)因子在血漿中測(cè)量的化學(xué)發(fā)光磁技術(shù)為基礎(chǔ)的自動(dòng)分析。他們的研究結(jié)果發(fā)表在2024年4月1日的《The Journal of Clinical Investigation》上。

圖1 可溶性免疫檢查點(diǎn)因子反映抗腫瘤免疫的耗竭和對(duì)PD-1阻斷的反應(yīng)
Hayashi教授分享了他們研究背后的靈感,他說:“諾貝爾醫(yī)學(xué)獎(jiǎng)得主Honjo教授建議,使用血液樣本而不是腫瘤組織,更動(dòng)態(tài)地了解腫瘤免疫環(huán)境是很重要的。”
研究小組評(píng)估了PD-1/PD-L1阻斷治療前晚期非小細(xì)胞肺癌患者血液樣本中免疫檢查點(diǎn)分子、PD-L1、PD-1和CTLA-4的可溶性形式。他們對(duì)50名接受納武單抗治療的患者進(jìn)行了一項(xiàng)前瞻性試驗(yàn),被稱為“發(fā)現(xiàn)隊(duì)列”。接受PD-1/PD-L1阻斷治療、細(xì)胞毒性化療或靶向治療等特異性治療的患者被分為不同的研究隊(duì)列,統(tǒng)稱為“驗(yàn)證隊(duì)列”,并進(jìn)行回顧性分析。他們發(fā)現(xiàn),在對(duì)PD-1/PD-L1阻斷治療無反應(yīng)的免疫反應(yīng)性腫瘤患者中,可溶性免疫檢查點(diǎn)因子濃度升高。相比之下,這種相關(guān)性在接受細(xì)胞毒性化療或靶向治療的患者中未見。
此外,對(duì)腫瘤大小、腫瘤組織和外周CD8+ T細(xì)胞中tPD-L1水平和基因表達(dá)的綜合分析表明,高水平的可溶性PD-L1、PD-1和CTLA-4與耗盡的抗腫瘤免疫相關(guān)。可溶性PD-L1和CTLA-4水平共同能夠有效預(yù)測(cè)熱性腫瘤(以各種浸潤(rùn)性免疫細(xì)胞高度浸潤(rùn)為特征的腫瘤)NSCLC患者PD-1/PD-L1阻斷治療的療效。
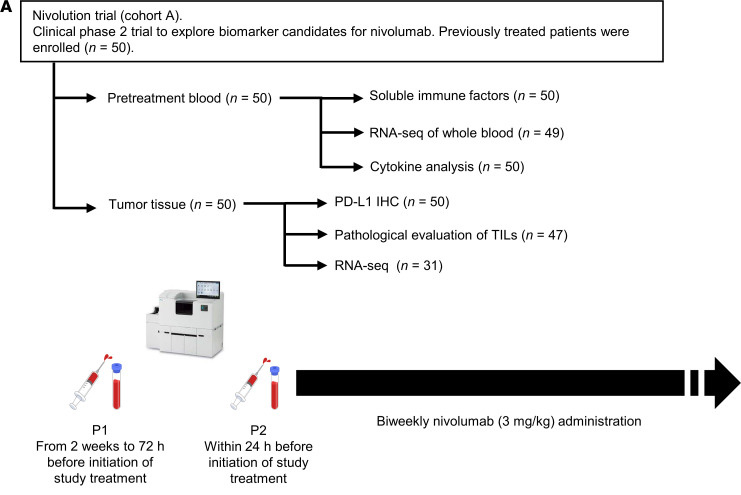
圖2 研究中包括的患者隊(duì)列和分析概述
“基于血液的可溶性標(biāo)記物可以較少侵入性地識(shí)別將從ici中獲益更多的患者,同時(shí)可能在效果意想不到的情況下提供另一種治療選擇。此外,對(duì)晚期非小細(xì)胞肺癌患者進(jìn)行適當(dāng)?shù)倪x擇性治療將延長(zhǎng)生存率,”Hayashi教授強(qiáng)調(diào)了他們的研究工作的潛在現(xiàn)實(shí)應(yīng)用。
因此,血漿中可溶性免疫檢查點(diǎn)分子作為生物標(biāo)志物的鑒定可以為晚期非小細(xì)胞肺癌患者更好的治療結(jié)果鋪平道路。
參考資料
[1] Soluble immune checkpoint factors reflect exhaustion of antitumor immunity and response to PD-1 blockade
摘要:來自日本的研究人員探索了可溶性免疫檢查點(diǎn)分子作為預(yù)測(cè)性生物標(biāo)志物的潛力。
癌癥是一種普遍的疾病,細(xì)胞不受控制地分裂和生長(zhǎng),并最終擴(kuò)散到身體的其他部位或器官。非小細(xì)胞肺癌(NSCLC)是一種非常普遍的肺癌。目前針對(duì)非小細(xì)胞肺癌的治療策略包括使用免疫檢查點(diǎn)抑制劑(ICIs),因?yàn)樗鼈優(yōu)榉切〖?xì)胞肺癌患者提供了顯著的臨床益處。
ICIs靶向特異性免疫檢查點(diǎn)蛋白,如細(xì)胞毒性T淋巴細(xì)胞相關(guān)蛋白-4 (CTLA-4)和/或程序性細(xì)胞死亡-1 (PD-1)。腫瘤組織中PD-1配體(PD-L1)的表達(dá)(tPD-L1)目前被用作確定非小細(xì)胞肺癌患者PD-1或PD-L1靶向治療療效的生物標(biāo)志物。然而,由于tPD-L1表達(dá)的異質(zhì)性和預(yù)測(cè)價(jià)值不足,需要額外的生物標(biāo)志物。
在此背景下,來自日本的一組研究人員,包括近代大學(xué)醫(yī)學(xué)院腫瘤內(nèi)科的Hidetoshi Hayashi教授和Kazuhiko Nakagawa教授,以及京都大學(xué)醫(yī)學(xué)院免疫與基因組醫(yī)學(xué)系的Kenji Chamoto教授和Tasuku Honjo教授,已嘗試研究可溶性形式的免疫檢查點(diǎn)因子在血漿中測(cè)量的化學(xué)發(fā)光磁技術(shù)為基礎(chǔ)的自動(dòng)分析。他們的研究結(jié)果發(fā)表在2024年4月1日的《The Journal of Clinical Investigation》上。

圖1 可溶性免疫檢查點(diǎn)因子反映抗腫瘤免疫的耗竭和對(duì)PD-1阻斷的反應(yīng)
Hayashi教授分享了他們研究背后的靈感,他說:“諾貝爾醫(yī)學(xué)獎(jiǎng)得主Honjo教授建議,使用血液樣本而不是腫瘤組織,更動(dòng)態(tài)地了解腫瘤免疫環(huán)境是很重要的。”
研究小組評(píng)估了PD-1/PD-L1阻斷治療前晚期非小細(xì)胞肺癌患者血液樣本中免疫檢查點(diǎn)分子、PD-L1、PD-1和CTLA-4的可溶性形式。他們對(duì)50名接受納武單抗治療的患者進(jìn)行了一項(xiàng)前瞻性試驗(yàn),被稱為“發(fā)現(xiàn)隊(duì)列”。接受PD-1/PD-L1阻斷治療、細(xì)胞毒性化療或靶向治療等特異性治療的患者被分為不同的研究隊(duì)列,統(tǒng)稱為“驗(yàn)證隊(duì)列”,并進(jìn)行回顧性分析。他們發(fā)現(xiàn),在對(duì)PD-1/PD-L1阻斷治療無反應(yīng)的免疫反應(yīng)性腫瘤患者中,可溶性免疫檢查點(diǎn)因子濃度升高。相比之下,這種相關(guān)性在接受細(xì)胞毒性化療或靶向治療的患者中未見。
此外,對(duì)腫瘤大小、腫瘤組織和外周CD8+ T細(xì)胞中tPD-L1水平和基因表達(dá)的綜合分析表明,高水平的可溶性PD-L1、PD-1和CTLA-4與耗盡的抗腫瘤免疫相關(guān)。可溶性PD-L1和CTLA-4水平共同能夠有效預(yù)測(cè)熱性腫瘤(以各種浸潤(rùn)性免疫細(xì)胞高度浸潤(rùn)為特征的腫瘤)NSCLC患者PD-1/PD-L1阻斷治療的療效。

圖2 研究中包括的患者隊(duì)列和分析概述
“基于血液的可溶性標(biāo)記物可以較少侵入性地識(shí)別將從ici中獲益更多的患者,同時(shí)可能在效果意想不到的情況下提供另一種治療選擇。此外,對(duì)晚期非小細(xì)胞肺癌患者進(jìn)行適當(dāng)?shù)倪x擇性治療將延長(zhǎng)生存率,”Hayashi教授強(qiáng)調(diào)了他們的研究工作的潛在現(xiàn)實(shí)應(yīng)用。
因此,血漿中可溶性免疫檢查點(diǎn)分子作為生物標(biāo)志物的鑒定可以為晚期非小細(xì)胞肺癌患者更好的治療結(jié)果鋪平道路。
參考資料
[1] Soluble immune checkpoint factors reflect exhaustion of antitumor immunity and response to PD-1 blockade



