摘要:研究人員揭示了非小細胞肺癌(NSCLC)腦轉移的關鍵驅動因子——阿爾茨海默病相關蛋白β-分泌酶1(BACE1)。
來自加拿大的研究人員Chafe團隊通過體內全基因組CRISPR激活篩選,揭示了非小細胞肺癌(NSCLC)腦轉移的關鍵驅動因子——阿爾茨海默病相關蛋白β-分泌酶1(BACE1)。研究發現BACE1通過表皮生長因子受體(EGFR)通路顯著促進腦轉移,而基因敲除或藥物抑制可阻斷該過程,為臨床BACE1抑制劑的應用提供了新依據。
 圖1 CD4+ T細胞允許庫普弗細胞逆轉肝細胞啟動誘導的CD8+ T細胞功能障礙
圖1 CD4+ T細胞允許庫普弗細胞逆轉肝細胞啟動誘導的CD8+ T細胞功能障礙非小細胞肺癌(NSCLC)患者中高達40%會發生腦轉移,但原發灶與轉移灶間的基因組異質性使驅動機制難以明確。這項研究采用患者來源的異種移植模型,通過體內全基因組CRISPR激活篩選技術,意外發現阿爾茨海默病相關蛋白β-分泌酶1(BACE1)的激活會顯著增加腦轉移發生率。臨床樣本分析顯示,NSCLC腦轉移患者的BACE1表達明顯富集。機制研究表明,BACE1通過調控表皮生長因子受體(EGFR)信號通路驅動轉移進程。更具臨床意義的是,無論是基因敲除還是使用BACE1抑制劑,都能有效阻斷癌細胞向腦部的擴散——這為已進入臨床試驗階段的BACE1抑制劑(原用于阿爾茨海默病治療)的腫瘤適應癥轉化提供了理論支撐。
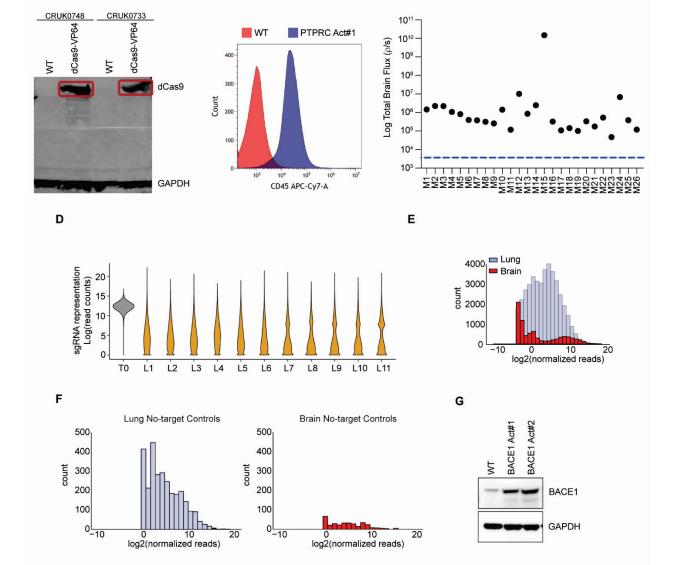
圖2 體內CRISPR激活篩選發現BACE1驅動肺腺癌腦轉移
該研究不僅證實了CRISPR激活篩選在揭示轉移機制方面的強大功能,更為NSCLC腦轉移患者帶來了潛在的新治療策略。
參考資料
[1] A genome-wide in vivo CRISPR activation screen identifies BACE1 as a therapeutic vulnerability of lung cancer brain metastasis
摘要:研究人員揭示了非小細胞肺癌(NSCLC)腦轉移的關鍵驅動因子——阿爾茨海默病相關蛋白β-分泌酶1(BACE1)。
來自加拿大的研究人員Chafe團隊通過體內全基因組CRISPR激活篩選,揭示了非小細胞肺癌(NSCLC)腦轉移的關鍵驅動因子——阿爾茨海默病相關蛋白β-分泌酶1(BACE1)。研究發現BACE1通過表皮生長因子受體(EGFR)通路顯著促進腦轉移,而基因敲除或藥物抑制可阻斷該過程,為臨床BACE1抑制劑的應用提供了新依據。
 圖1 CD4+ T細胞允許庫普弗細胞逆轉肝細胞啟動誘導的CD8+ T細胞功能障礙
圖1 CD4+ T細胞允許庫普弗細胞逆轉肝細胞啟動誘導的CD8+ T細胞功能障礙非小細胞肺癌(NSCLC)患者中高達40%會發生腦轉移,但原發灶與轉移灶間的基因組異質性使驅動機制難以明確。這項研究采用患者來源的異種移植模型,通過體內全基因組CRISPR激活篩選技術,意外發現阿爾茨海默病相關蛋白β-分泌酶1(BACE1)的激活會顯著增加腦轉移發生率。臨床樣本分析顯示,NSCLC腦轉移患者的BACE1表達明顯富集。機制研究表明,BACE1通過調控表皮生長因子受體(EGFR)信號通路驅動轉移進程。更具臨床意義的是,無論是基因敲除還是使用BACE1抑制劑,都能有效阻斷癌細胞向腦部的擴散——這為已進入臨床試驗階段的BACE1抑制劑(原用于阿爾茨海默病治療)的腫瘤適應癥轉化提供了理論支撐。

圖2 體內CRISPR激活篩選發現BACE1驅動肺腺癌腦轉移
該研究不僅證實了CRISPR激活篩選在揭示轉移機制方面的強大功能,更為NSCLC腦轉移患者帶來了潛在的新治療策略。
參考資料
[1] A genome-wide in vivo CRISPR activation screen identifies BACE1 as a therapeutic vulnerability of lung cancer brain metastasis



