摘要:研究人員開展了細(xì)胞內(nèi)蛋白質(zhì)編輯技術(shù)的研究。
在哺乳動物細(xì)胞中原位研究蛋白質(zhì),對于深入理解真核細(xì)胞生物學(xué)至關(guān)重要。為了在活的哺乳動物細(xì)胞中研究蛋白質(zhì),通常需要給目標(biāo)蛋白添加氨基酸(從相對較小的肽到較大的融合蛋白不等)作為實(shí)驗(yàn) “抓手”,以此在整個實(shí)驗(yàn)過程中追蹤或控制目標(biāo)蛋白。這些標(biāo)簽雖然給細(xì)胞內(nèi)蛋白質(zhì)研究帶來了變革,但也存在局限性:它們可能影響目標(biāo)蛋白的特性,并且在研究動態(tài)過程時大多缺乏時間分辨率。化學(xué)標(biāo)簽因其體積小、種類多樣(超出了基因編碼的氨基酸范圍)而具有優(yōu)勢,然而將其應(yīng)用于哺乳動物細(xì)胞中的蛋白質(zhì)卻困難重重。顯然,在活的哺乳動物細(xì)胞中標(biāo)記和操縱蛋白質(zhì),需要新技術(shù)的支持。
受化學(xué)生物學(xué)和基因編輯領(lǐng)域最新進(jìn)展的啟發(fā),研究人員設(shè)想出一種能夠在哺乳動物細(xì)胞內(nèi)對蛋白質(zhì)一級序列進(jìn)行翻譯后編輯的技術(shù),這種技術(shù)還能作用于最能代表天然生物學(xué)狀態(tài)的內(nèi)源性蛋白質(zhì)。該系統(tǒng)能夠在用戶指定的位點(diǎn),將外源蛋白質(zhì)片段拼接到目標(biāo)蛋白中,實(shí)現(xiàn)時間上的精準(zhǔn)控制,還能引入有用的標(biāo)記和非經(jīng)典氨基酸(noncanonical amino acids,ncAAs) 。為實(shí)現(xiàn)這一目標(biāo),研究人員設(shè)計(jì)了一種細(xì)胞內(nèi)蛋白質(zhì)編輯系統(tǒng),該系統(tǒng)依賴兩對分裂內(nèi)含肽(split intein) 蛋白,這些蛋白可以分別連接多肽鏈。串聯(lián)使用時,這些分裂內(nèi)含肽能夠?qū)⒐w肽編輯到目標(biāo)蛋白內(nèi)部的受體位點(diǎn)。受體序列可以通過基因組編輯插入內(nèi)源性蛋白,也可以插入外源表達(dá)的蛋白中。相應(yīng)的供體蛋白通過重組產(chǎn)生,這樣一來,如果有需要,就能大規(guī)模整合非經(jīng)典氨基酸并進(jìn)行化學(xué)標(biāo)記。將供體蛋白導(dǎo)入活的哺乳動物細(xì)胞后,就能快速把供體編輯到目標(biāo)蛋白中。
 圖1 細(xì)胞內(nèi)蛋白質(zhì)編輯能夠在內(nèi)源性蛋白質(zhì)中引入非經(jīng)典氨基酸殘基
圖1 細(xì)胞內(nèi)蛋白質(zhì)編輯能夠在內(nèi)源性蛋白質(zhì)中引入非經(jīng)典氨基酸殘基研究人員首先展示了一種通用的編輯方法,即將含有抗原決定簇標(biāo)簽的通用最小供體,編輯到模型蛋白鈣連蛋白(calnexin)和 β - 肌動蛋白(β -actin)中。通過免疫印跡、熒光顯微鏡和基于質(zhì)譜的蛋白質(zhì)組學(xué)技術(shù),他們證實(shí)了蛋白質(zhì)一級序列發(fā)生了編輯。時間特性分析顯示,在供體蛋白導(dǎo)入 10 分鐘內(nèi)就會發(fā)生編輯,這使得在生物學(xué)相關(guān)的時間尺度上開展實(shí)驗(yàn)成為可能。研究人員還展示了一種序列特異性編輯模式,轉(zhuǎn)錄因子 c - Myc 和激酶 Chk1 幾乎無痕地被編輯,從而能夠?qū)@些動態(tài)蛋白質(zhì)進(jìn)行時間分辨研究。此外,利用蛋白質(zhì)組學(xué)和轉(zhuǎn)錄組學(xué)方法,研究人員發(fā)現(xiàn) Chk1 和 c - Myc 在編輯后仍然保持功能,這證明了該蛋白質(zhì)編輯技術(shù)近乎無痕且干擾極小。
此外,研究人員在大腸桿菌(Escherichia coli)中利用基因編碼擴(kuò)展技術(shù),將非經(jīng)典氨基酸和點(diǎn)擊化學(xué)手柄對疊氮基苯丙氨酸(p-azido-phenylalanine,pAzF)編碼到供體蛋白中,然后再用小分子進(jìn)行標(biāo)記。之后,他們將小分子熒光團(tuán)或生物素編輯到內(nèi)源性鈣連蛋白中,實(shí)現(xiàn)了對內(nèi)源性蛋白質(zhì)的顯微鏡觀察和下拉實(shí)驗(yàn),而且無需使用抗體。
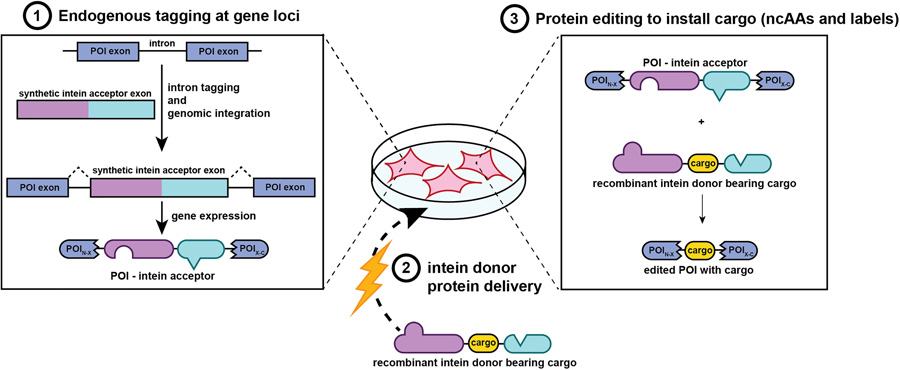
圖2 細(xì)胞內(nèi)蛋白質(zhì)編輯
這項(xiàng)研究建立了一種在活的哺乳動物細(xì)胞中編輯蛋白質(zhì)一級氨基酸序列的方法。該方法能夠在目標(biāo)蛋白(包括內(nèi)源性蛋白)中,實(shí)現(xiàn)非經(jīng)典氨基酸和有用標(biāo)記的位點(diǎn)特異性編輯。最終,該技術(shù)能夠以無干擾且具有時間分辨率的方式標(biāo)記和操縱蛋白質(zhì)。這種蛋白質(zhì)編輯方法是研究哺乳動物細(xì)胞中蛋白質(zhì)的技術(shù)寶庫中一項(xiàng)實(shí)用且應(yīng)用廣泛的新成員,有望在各種應(yīng)用場景中,對幾乎無窮無盡的目標(biāo)蛋白進(jìn)行編輯、操縱和觀察。
參考資料
[1] Intracellular protein editing enables incorporation of noncanonical residues in endogenous proteins
摘要:研究人員開展了細(xì)胞內(nèi)蛋白質(zhì)編輯技術(shù)的研究。
在哺乳動物細(xì)胞中原位研究蛋白質(zhì),對于深入理解真核細(xì)胞生物學(xué)至關(guān)重要。為了在活的哺乳動物細(xì)胞中研究蛋白質(zhì),通常需要給目標(biāo)蛋白添加氨基酸(從相對較小的肽到較大的融合蛋白不等)作為實(shí)驗(yàn) “抓手”,以此在整個實(shí)驗(yàn)過程中追蹤或控制目標(biāo)蛋白。這些標(biāo)簽雖然給細(xì)胞內(nèi)蛋白質(zhì)研究帶來了變革,但也存在局限性:它們可能影響目標(biāo)蛋白的特性,并且在研究動態(tài)過程時大多缺乏時間分辨率。化學(xué)標(biāo)簽因其體積小、種類多樣(超出了基因編碼的氨基酸范圍)而具有優(yōu)勢,然而將其應(yīng)用于哺乳動物細(xì)胞中的蛋白質(zhì)卻困難重重。顯然,在活的哺乳動物細(xì)胞中標(biāo)記和操縱蛋白質(zhì),需要新技術(shù)的支持。
受化學(xué)生物學(xué)和基因編輯領(lǐng)域最新進(jìn)展的啟發(fā),研究人員設(shè)想出一種能夠在哺乳動物細(xì)胞內(nèi)對蛋白質(zhì)一級序列進(jìn)行翻譯后編輯的技術(shù),這種技術(shù)還能作用于最能代表天然生物學(xué)狀態(tài)的內(nèi)源性蛋白質(zhì)。該系統(tǒng)能夠在用戶指定的位點(diǎn),將外源蛋白質(zhì)片段拼接到目標(biāo)蛋白中,實(shí)現(xiàn)時間上的精準(zhǔn)控制,還能引入有用的標(biāo)記和非經(jīng)典氨基酸(noncanonical amino acids,ncAAs) 。為實(shí)現(xiàn)這一目標(biāo),研究人員設(shè)計(jì)了一種細(xì)胞內(nèi)蛋白質(zhì)編輯系統(tǒng),該系統(tǒng)依賴兩對分裂內(nèi)含肽(split intein) 蛋白,這些蛋白可以分別連接多肽鏈。串聯(lián)使用時,這些分裂內(nèi)含肽能夠?qū)⒐w肽編輯到目標(biāo)蛋白內(nèi)部的受體位點(diǎn)。受體序列可以通過基因組編輯插入內(nèi)源性蛋白,也可以插入外源表達(dá)的蛋白中。相應(yīng)的供體蛋白通過重組產(chǎn)生,這樣一來,如果有需要,就能大規(guī)模整合非經(jīng)典氨基酸并進(jìn)行化學(xué)標(biāo)記。將供體蛋白導(dǎo)入活的哺乳動物細(xì)胞后,就能快速把供體編輯到目標(biāo)蛋白中。
 圖1 細(xì)胞內(nèi)蛋白質(zhì)編輯能夠在內(nèi)源性蛋白質(zhì)中引入非經(jīng)典氨基酸殘基
圖1 細(xì)胞內(nèi)蛋白質(zhì)編輯能夠在內(nèi)源性蛋白質(zhì)中引入非經(jīng)典氨基酸殘基研究人員首先展示了一種通用的編輯方法,即將含有抗原決定簇標(biāo)簽的通用最小供體,編輯到模型蛋白鈣連蛋白(calnexin)和 β - 肌動蛋白(β -actin)中。通過免疫印跡、熒光顯微鏡和基于質(zhì)譜的蛋白質(zhì)組學(xué)技術(shù),他們證實(shí)了蛋白質(zhì)一級序列發(fā)生了編輯。時間特性分析顯示,在供體蛋白導(dǎo)入 10 分鐘內(nèi)就會發(fā)生編輯,這使得在生物學(xué)相關(guān)的時間尺度上開展實(shí)驗(yàn)成為可能。研究人員還展示了一種序列特異性編輯模式,轉(zhuǎn)錄因子 c - Myc 和激酶 Chk1 幾乎無痕地被編輯,從而能夠?qū)@些動態(tài)蛋白質(zhì)進(jìn)行時間分辨研究。此外,利用蛋白質(zhì)組學(xué)和轉(zhuǎn)錄組學(xué)方法,研究人員發(fā)現(xiàn) Chk1 和 c - Myc 在編輯后仍然保持功能,這證明了該蛋白質(zhì)編輯技術(shù)近乎無痕且干擾極小。
此外,研究人員在大腸桿菌(Escherichia coli)中利用基因編碼擴(kuò)展技術(shù),將非經(jīng)典氨基酸和點(diǎn)擊化學(xué)手柄對疊氮基苯丙氨酸(p-azido-phenylalanine,pAzF)編碼到供體蛋白中,然后再用小分子進(jìn)行標(biāo)記。之后,他們將小分子熒光團(tuán)或生物素編輯到內(nèi)源性鈣連蛋白中,實(shí)現(xiàn)了對內(nèi)源性蛋白質(zhì)的顯微鏡觀察和下拉實(shí)驗(yàn),而且無需使用抗體。

圖2 細(xì)胞內(nèi)蛋白質(zhì)編輯
這項(xiàng)研究建立了一種在活的哺乳動物細(xì)胞中編輯蛋白質(zhì)一級氨基酸序列的方法。該方法能夠在目標(biāo)蛋白(包括內(nèi)源性蛋白)中,實(shí)現(xiàn)非經(jīng)典氨基酸和有用標(biāo)記的位點(diǎn)特異性編輯。最終,該技術(shù)能夠以無干擾且具有時間分辨率的方式標(biāo)記和操縱蛋白質(zhì)。這種蛋白質(zhì)編輯方法是研究哺乳動物細(xì)胞中蛋白質(zhì)的技術(shù)寶庫中一項(xiàng)實(shí)用且應(yīng)用廣泛的新成員,有望在各種應(yīng)用場景中,對幾乎無窮無盡的目標(biāo)蛋白進(jìn)行編輯、操縱和觀察。
參考資料
[1] Intracellular protein editing enables incorporation of noncanonical residues in endogenous proteins



