摘要:人類早期的發(fā)育不是由我們自己的基因控制的,而是由散布在基因組周圍的“自私的DNA”控制的。
西奈健康中心的研究人員發(fā)現(xiàn),人類早期發(fā)育的一個關(guān)鍵轉(zhuǎn)變不是由我們自己的基因控制的,而是由一種叫做轉(zhuǎn)座子的DNA元素控制的,這種元素可以在基因組中移動。
這一非凡的發(fā)現(xiàn)挑戰(zhàn)了我們之前對這些難以捉摸的DNA片段的理解,為它們在人類發(fā)育和疾病中所起的作用提供了新的視角。

圖1 LINE1和PRC2控制人類胚胎干細胞核仁組織和8C狀態(tài)的抑制
“人們傾向于認為轉(zhuǎn)座子類似于病毒,它們劫持我們的細胞的唯一目的是繁殖自己,”該研究的資深合著者Miguel Ramalho-Santos博士說。
“但在這里,我們發(fā)現(xiàn)這些元素不僅僅是基因組寄生蟲,而且對早期發(fā)育至關(guān)重要,”Ramalho-Santos博士說,他是加拿大150名發(fā)育表觀遺傳學(xué)研究主席。
他們發(fā)表在《發(fā)育細胞》(Developmental Cell)雜志上的研究表明,轉(zhuǎn)座因子對于確保人類胚胎細胞在早期正常發(fā)育(而不是回到過去)至關(guān)重要。
研究人員專注于被稱為LINE-1的轉(zhuǎn)座元素,即長時間散布的核元素-1。我們自己的基因只占我們基因組的不到2%,而line -1元素在我們細胞中的遺傳物質(zhì)中占了驚人的20%。一些LINE-1元素可以在基因組中擴增和移動,將自己插入新的位置。因為它們以一種可以破壞正常基因功能的方式自行傳播,這為它們贏得了“自私DNA”的綽號。
多年來,科學(xué)家們認為這些元素大多是有害的,偶爾會對基因組造成嚴重破壞,并導(dǎo)致血友病、神經(jīng)系統(tǒng)疾病和癌癥等多種疾病。
該研究的資深合著者、博士后Juan Zhang最初發(fā)現(xiàn),LINE-1 RNA信息在早期胚胎中非常豐富,這很有趣。RNA信息分子是從活躍的基因組部分轉(zhuǎn)錄出來的,這表明LINE-1元素在這些關(guān)鍵的早期階段被打開。
“如果轉(zhuǎn)座子是有害和危險的,為什么我們看到它們在早期胚胎中活躍?”這是一個剛開始形成的胚胎。在這一點上,任何對基因組的危險插入都將在個體的其余發(fā)育過程中傳播,”張博士說。
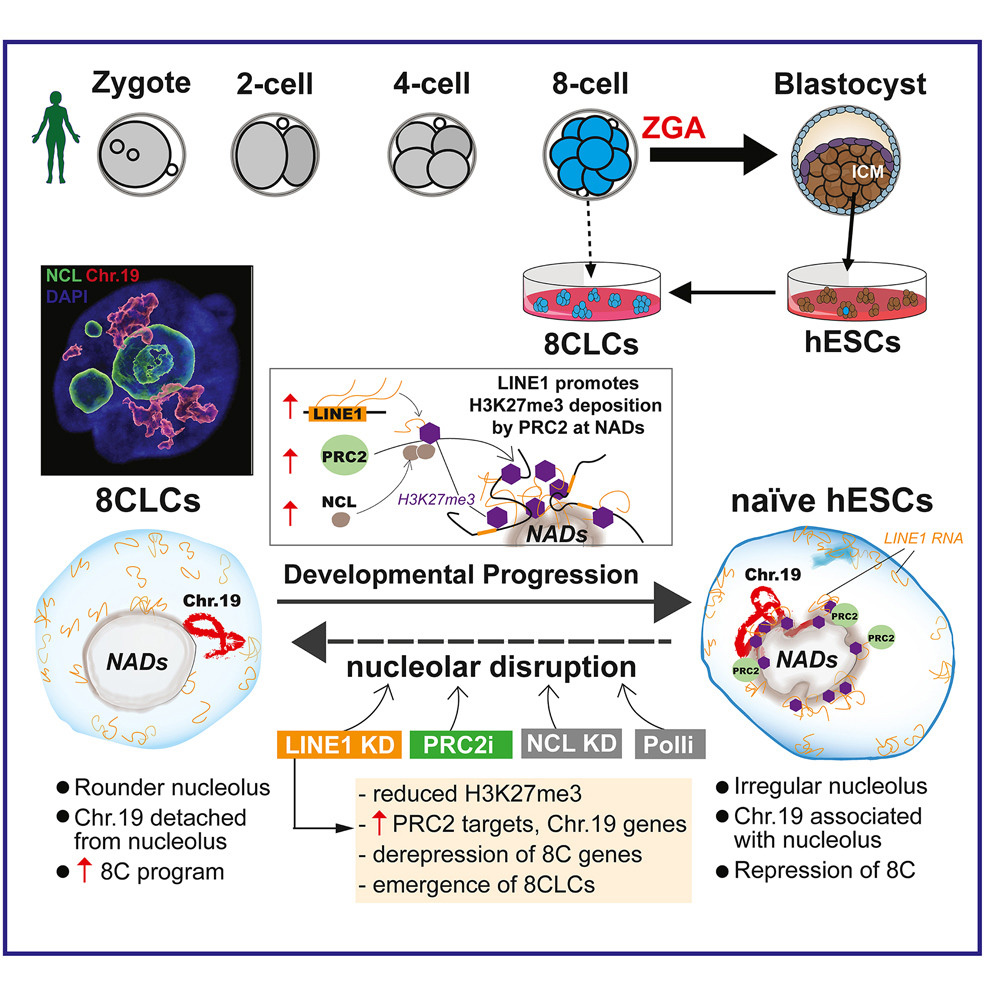
圖2 LINE1家族阻止了人類胚胎干細胞(hESC)向8細胞樣細胞(8CLC)的逆轉(zhuǎn)
當張博士在培養(yǎng)的人類胚胎干細胞(ESCs)中抑制LINE-1表達時,逆轉(zhuǎn)發(fā)生了,使它們回到更原始的8細胞階段。此時,這8個細胞中的每一個都是相同的和全能性的,能夠發(fā)育成胚胎和胎盤。然而,在這一階段之后,雖然ESCs仍然可以形成所有的胎兒細胞,但它們對胎盤的貢獻越來越少,胚胎通過胎盤從母親那里獲得營養(yǎng)。
進一步的實驗表明,這些LINE-1信息分子作為一個支架,在細胞核的三維空間中組織DNA。它們幫助19號染色體轉(zhuǎn)移到8細胞階段的關(guān)鍵基因——細胞核的基因沉默區(qū)域,確保胚胎能夠順利進入后續(xù)階段。
“我們發(fā)現(xiàn)LINE-1在一個關(guān)鍵的轉(zhuǎn)折點上調(diào)節(jié)基因表達,在這個轉(zhuǎn)折點上胚胎開始將細胞特化以實現(xiàn)各種功能。我們的研究結(jié)果表明,這不是偶然發(fā)生的,而是一種重要的進化機制。”
更令人驚訝的是,LINE-1元素的新角色偏離了它們跳到新的基因組位置的典型行為,從而導(dǎo)致潛在的有害突變。相反,在這種關(guān)鍵的背景下,LINE-1元素只促進發(fā)育進程,這種獨特的作用強調(diào)了它們在早期人類生長中的重要性。
這項基礎(chǔ)研究對生育治療和干細胞在再生醫(yī)學(xué)中的應(yīng)用具有重要意義。此外,這項工作揭示了LINE1的新作用,現(xiàn)在可以在從神經(jīng)系統(tǒng)疾病到癌癥的疾病背景中探索LINE1。
LTRI主任兼西奈健康研究副總裁Anne-Claude Gingras博士說:“這項研究強調(diào)了有多少東西需要學(xué)習(xí),不僅是關(guān)于人類發(fā)展,而且關(guān)于這些神秘的基因組元件,它們的作用才剛剛開始顯現(xiàn)。我祝賀我的同事們在人類生物學(xué)的這一引人入勝的見解方面取得了新的突破,我熱切地期待著他們在繼續(xù)他們的工作時能有更多的發(fā)現(xiàn)。”
參考資料
[1] LINE1 and PRC2 control nucleolar organization and repression of the 8C state in human ESCs
摘要:人類早期的發(fā)育不是由我們自己的基因控制的,而是由散布在基因組周圍的“自私的DNA”控制的。
西奈健康中心的研究人員發(fā)現(xiàn),人類早期發(fā)育的一個關(guān)鍵轉(zhuǎn)變不是由我們自己的基因控制的,而是由一種叫做轉(zhuǎn)座子的DNA元素控制的,這種元素可以在基因組中移動。
這一非凡的發(fā)現(xiàn)挑戰(zhàn)了我們之前對這些難以捉摸的DNA片段的理解,為它們在人類發(fā)育和疾病中所起的作用提供了新的視角。

圖1 LINE1和PRC2控制人類胚胎干細胞核仁組織和8C狀態(tài)的抑制
“人們傾向于認為轉(zhuǎn)座子類似于病毒,它們劫持我們的細胞的唯一目的是繁殖自己,”該研究的資深合著者Miguel Ramalho-Santos博士說。
“但在這里,我們發(fā)現(xiàn)這些元素不僅僅是基因組寄生蟲,而且對早期發(fā)育至關(guān)重要,”Ramalho-Santos博士說,他是加拿大150名發(fā)育表觀遺傳學(xué)研究主席。
他們發(fā)表在《發(fā)育細胞》(Developmental Cell)雜志上的研究表明,轉(zhuǎn)座因子對于確保人類胚胎細胞在早期正常發(fā)育(而不是回到過去)至關(guān)重要。
研究人員專注于被稱為LINE-1的轉(zhuǎn)座元素,即長時間散布的核元素-1。我們自己的基因只占我們基因組的不到2%,而line -1元素在我們細胞中的遺傳物質(zhì)中占了驚人的20%。一些LINE-1元素可以在基因組中擴增和移動,將自己插入新的位置。因為它們以一種可以破壞正常基因功能的方式自行傳播,這為它們贏得了“自私DNA”的綽號。
多年來,科學(xué)家們認為這些元素大多是有害的,偶爾會對基因組造成嚴重破壞,并導(dǎo)致血友病、神經(jīng)系統(tǒng)疾病和癌癥等多種疾病。
該研究的資深合著者、博士后Juan Zhang最初發(fā)現(xiàn),LINE-1 RNA信息在早期胚胎中非常豐富,這很有趣。RNA信息分子是從活躍的基因組部分轉(zhuǎn)錄出來的,這表明LINE-1元素在這些關(guān)鍵的早期階段被打開。
“如果轉(zhuǎn)座子是有害和危險的,為什么我們看到它們在早期胚胎中活躍?”這是一個剛開始形成的胚胎。在這一點上,任何對基因組的危險插入都將在個體的其余發(fā)育過程中傳播,”張博士說。

圖2 LINE1家族阻止了人類胚胎干細胞(hESC)向8細胞樣細胞(8CLC)的逆轉(zhuǎn)
當張博士在培養(yǎng)的人類胚胎干細胞(ESCs)中抑制LINE-1表達時,逆轉(zhuǎn)發(fā)生了,使它們回到更原始的8細胞階段。此時,這8個細胞中的每一個都是相同的和全能性的,能夠發(fā)育成胚胎和胎盤。然而,在這一階段之后,雖然ESCs仍然可以形成所有的胎兒細胞,但它們對胎盤的貢獻越來越少,胚胎通過胎盤從母親那里獲得營養(yǎng)。
進一步的實驗表明,這些LINE-1信息分子作為一個支架,在細胞核的三維空間中組織DNA。它們幫助19號染色體轉(zhuǎn)移到8細胞階段的關(guān)鍵基因——細胞核的基因沉默區(qū)域,確保胚胎能夠順利進入后續(xù)階段。
“我們發(fā)現(xiàn)LINE-1在一個關(guān)鍵的轉(zhuǎn)折點上調(diào)節(jié)基因表達,在這個轉(zhuǎn)折點上胚胎開始將細胞特化以實現(xiàn)各種功能。我們的研究結(jié)果表明,這不是偶然發(fā)生的,而是一種重要的進化機制。”
更令人驚訝的是,LINE-1元素的新角色偏離了它們跳到新的基因組位置的典型行為,從而導(dǎo)致潛在的有害突變。相反,在這種關(guān)鍵的背景下,LINE-1元素只促進發(fā)育進程,這種獨特的作用強調(diào)了它們在早期人類生長中的重要性。
這項基礎(chǔ)研究對生育治療和干細胞在再生醫(yī)學(xué)中的應(yīng)用具有重要意義。此外,這項工作揭示了LINE1的新作用,現(xiàn)在可以在從神經(jīng)系統(tǒng)疾病到癌癥的疾病背景中探索LINE1。
LTRI主任兼西奈健康研究副總裁Anne-Claude Gingras博士說:“這項研究強調(diào)了有多少東西需要學(xué)習(xí),不僅是關(guān)于人類發(fā)展,而且關(guān)于這些神秘的基因組元件,它們的作用才剛剛開始顯現(xiàn)。我祝賀我的同事們在人類生物學(xué)的這一引人入勝的見解方面取得了新的突破,我熱切地期待著他們在繼續(xù)他們的工作時能有更多的發(fā)現(xiàn)。”
參考資料
[1] LINE1 and PRC2 control nucleolar organization and repression of the 8C state in human ESCs



